Окружной суд США, тем временем, постановляет раскрыть все запечатанные документы в судебном процессе по делу Пропеции.
1 февраля 2021 г.
Дорогие друзья:
Фонд ПФС подал дополнительные материалы к гражданской петиции FDA с просьбой, чтобы агентство «немедленно потребовало отзыва разрешения на продажу Пропеции… потому что риск серьезной травмы от препарата перевешивает его ограниченные преимущества».
Эти два дополнения были поданы 1 декабря 2020 года и опубликованы в конце прошлого месяца на сайте Regulations.gov, веб-сайте федерального правительства США, который служит хранилищем документов, позволяющим гражданам участвовать в процессах нормотворчества некоторых государственных учреждений.
Приложение к петиции №1 содержит научные исследования, эпидемиологические данные и другую соответствующую информацию, которая была опубликована после подачи нашей гражданской петиции 19 сентября 2017 года, в том числе:
- Лечение крыс-самцов финастеридом, ингибитором фермента 5альфа-редуктазы, вызывает длительное воздействие на депрессивно-подобное поведение, нейрогенез гиппокампа, нейровоспаление и состав микробиоты кишечника.
- Ингибитор стероидогенеза финастерид снижает реакцию как на стрессовые, так и на стимулирующие раздражители.
(б) Клинические исследования
- Измененная структура метилирования гена SRD5A2 в спинномозговой жидкости пациентов, перенесших финастерид: пилотное исследование.
- Сосудистые аномалии полового члена у молодых мужчин со стойкими побочными эффектами после применения финастерида для лечения андрогенной алопеции, Финастерид и Суицид: Серия постмаркетинговых случаев
- Исследование суицидальности и психологических побочных эффектов у пациентов, принимавших финастерид.
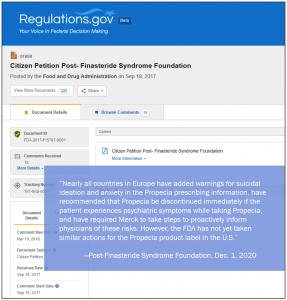 (c) Агентства по регулированию лекарственных средств за пределами США. Фонд пишет:
(c) Агентства по регулированию лекарственных средств за пределами США. Фонд пишет:
Почти все страны Европы добавили предупреждения о суицидальных мыслях и тревоге в инструкцию по применению Пропеции, рекомендовали немедленно прекратить прием Пропеции, если у пациента наблюдаются психиатрические симптомы во время приема Пропеции, и потребовали от компании Merck принять меры для активного информирования врачей об этих рисках. Однако FDA еще не предприняло аналогичных действий касательно этикетки препарата Пропеция в США:
- Министерство здравоохранения Канады: Краткий обзор безопасности для Пропеции и Проскар
- Агентство по регулированию лекарственных средств и товаров медицинского назначения (Великобритания): Обзор характеристик препарата Пропеция
- Европейское агентство по лекарственным средствам: позиция CMDh в отношении предупреждения о тревоге в «Сводке характеристик продукта Пропеция», EMA
- Федеральный институт лекарств и медицинских устройств (BfArM, Германия): Письмо с пометкой Красной Руки о финастериде
- Национальное агентство по безопасности лекарственных средств и товаров медицинского назначения (ANSM France)
Приложение к петиции №2 ссылается исключительно на отчет Reuters, озаглавленный «Суд позволил Merck скрыть секреты о рисках, связанных с популярным лекарством».
История Дэна Левайна, опубликованная 11 сентября 2019 года после годичного расследования, раскрыла свидетельские показания бывших руководителей Merck в судебном процессе по делу Пропеции в США, предполагающие, что фармацевтический гигант преуменьшил побочные эффекты препарата во время клинических испытаний. В частности, компания Merck обнаружила доказательства стойких побочных эффектов в своих первоначальных клинических исследованиях финастерида, но не указала их на этикетке с предупреждением.
Усугубляя положение отсутствия прозрачности, судья Брайан Коган необъяснимым образом позволил компании Merck и адвокатам истцов сохранить конфиденциальность информации, представленной в суд. Как объяснил Левин, об отчете которого также указано в новостях о нашей Гражданской петиции:
Некоторые из этих документов проскользнули сквозь трещины секретности. Один был непреднамеренно внесен в публичный архив, сохраняясь в открытом доступе в течение года, прежде чем был опечатан, но тем временем он попал в малоизвестный публичный архив, где его нашел Reuters. Другой был ошибочно отредактирован, что позволило репортеру его прочитать.
Среди этих документов были показания Шарлотты Мерритт, руководившей регламентирующей деятельностью для Пропеции, и Пола Хауза, возглавлявшего маркетинг рецептурных лекарств.
 Мерритт признала, что в 2002 году, через четыре года после того, как Пропеция вышла на рынок, Merck изменил маркировку препарата в отношении побочных эффектов сексуального характера с «выздоровление произошло у всех мужчин, прекративших принятие Пропецию» на «выздоровление произошло у мужчин, которые прекратили принимать Пропецию». Затем она дала показания, что Merck исключила слово «все» из-за свидетельств клинических исследований о том, что побочные эффекты не исчезают после того, как пациенты прекратили прием препарата.
Мерритт признала, что в 2002 году, через четыре года после того, как Пропеция вышла на рынок, Merck изменил маркировку препарата в отношении побочных эффектов сексуального характера с «выздоровление произошло у всех мужчин, прекративших принятие Пропецию» на «выздоровление произошло у мужчин, которые прекратили принимать Пропецию». Затем она дала показания, что Merck исключила слово «все» из-за свидетельств клинических исследований о том, что побочные эффекты не исчезают после того, как пациенты прекратили прием препарата.
Хоус признал, что Merck знала, что предупреждения о побочных эффектах сексуального характера, особенно о стойких и необратимых, обернулись бы концом для продаж Пропеции.
На следующий день после того, как история Левайна стала известна, агентство Reuters подало ходатайство в Федеральный суд США о вскрытии всех документов, поданных в ходе судебного разбирательства по делу Пропеции. Крупнейшее информационное агентство в западном мире заявило, что «это дело особой важности, которое было закрыто без официально зарегистрированных результатов, объясняющих его заключение. Первая поправка исключает такой исход ».
Шестнадцать месяцев спустя, 25 января, мировой судья США Пегги Куо одобрила ходатайство Reuters, открыв доступ к обнародованию всех документов Merck в судебном процессе, связанном с Пропецией.
В своем решении Куо отметила, что аргументы Merck в пользу того, чтобы эти документы не закрывались, «являются настолько слабыми, что они не смогут преодолеть даже низкую презумпцию доступа согласно общему праву».
 Если Вы живете в США и страдаете от ПФС, сообщите о своих симптомах в Управление по контролю за продуктами и лекарствами США (FDA). Если Вы живете за пределами США и страдаете от ПФС, сообщите о своих симптомах в Управление по контролю за продуктами и лекарствами США (FDA), а также в Ваше национальное Учреждение по Контролю за Лекарственными Средствами, как указано на странице «Сообщите о своих побочных эффектах».
Если Вы живете в США и страдаете от ПФС, сообщите о своих симптомах в Управление по контролю за продуктами и лекарствами США (FDA). Если Вы живете за пределами США и страдаете от ПФС, сообщите о своих симптомах в Управление по контролю за продуктами и лекарствами США (FDA), а также в Ваше национальное Учреждение по Контролю за Лекарственными Средствами, как указано на странице «Сообщите о своих побочных эффектах».
Если Вы или Ваш близкий человек страдаете от ПФС и Вы чувствуете себя подавленными или находитесь в эмоционально неустойчивом состоянии, не стесняйтесь обращаться в Фонд ПФС по Горячей Линии Поддержки Пациентов: social@pfsfoundation.org
Спасибо.
Новости по теме
Regulatory Update: France’s FDA-Equivalent Agency Reissues Finasteride Warning (Feb. 2, 2019)
Regulatory Update: MHRA Issues Drug Safety Update on Finasteride (May 26, 2017)
