Mientras tanto, el Tribunal de Distrito de los EE. UU. Ordena que todos los documentos sellados en el litigio de Propecia sean abiertos
1 de febrero de 2021
Queridos amigos:
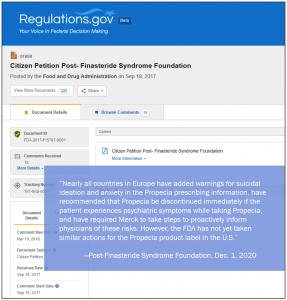 La Fundación PFS ha presentado suplementos a su Petición Ciudadana de la FDA solicitando que la agencia «requiera inmediatamente el retiro de la aprobación de comercialización para Propecia … porque el riesgo de lesiones graves por el medicamento supera sus beneficios limitados».
La Fundación PFS ha presentado suplementos a su Petición Ciudadana de la FDA solicitando que la agencia «requiera inmediatamente el retiro de la aprobación de comercialización para Propecia … porque el riesgo de lesiones graves por el medicamento supera sus beneficios limitados».
Los dos suplementos se presentaron el 1 de diciembre de 2020 y se publicaron a fines del mes pasado en Regulations.gov, un sitio web del gobierno federal de los EE. UU. Que sirve como un depósito de documentos que permite a los ciudadanos participar en los procesos de elaboración de reglas de algunas agencias gubernamentales.
El Suplemento de Petición 1 contiene investigaciones científicas, datos epidemiológicos y otra información pertinente que se publicó después de que se presentó nuestra Petición de Ciudadano el 19 de septiembre de 2017, que incluye:
(a) Estudios con animales
(b) Estudios clínicos
(c) Agencias reguladoras de medicamentos fuera de los EE. UU. La fundación escribe:
Casi todos los países de Europa han agregado advertencias sobre ideación suicida y ansiedad en la información de prescripción de Propecia, han recomendado que Propecia se suspenda inmediatamente si el paciente experimenta síntomas psiquiátricos mientras toma Propecia, y han requerido que Merck tome medidas para informar proactivamente a los médicos sobre estos riesgos. . Sin embargo, la FDA aún no ha tomado medidas similares para la etiqueta del producto Propecia en los Estados Unidos:
- Health Canada: Summary Safety Review for Propecia and Proscar
- Medicines and Healthcare Products Regulatory Agency (UK): Propecia Summary of Product Characteristics
- European Medicines Agency: CMDh position regarding anxiety warning on Propecia Summary of Product Characteristics, EMA
- Federal Institute for Drugs and Medical Devices (BfArM Germany): Finasteride Red Hand Letter
- National Agency for the Safety of Medicines and Health Products (ANSM France)
El Suplemento 2 de la petición se refiere exclusivamente a un informe de Reuters titulado Court permitió a Merck ocultar secretos sobre los riesgos de una droga popular.
Publicada el 11 de septiembre de 2019 después de una investigación de un año, la historia de Dan Levine descubrió el testimonio de ex ejecutivos de Merck en el litigio de Propecia en EE. UU. Se sugiere que el gigante farmacéutico minimice los efectos secundarios del medicamento durante los ensayos clínicos. Específicamente, Merck encontró evidencia de efectos secundarios persistentes en sus ensayos clínicos originales de finasterida, pero no los reveló en su etiqueta de advertencia.
Para agravar esta falta de transparencia, el juez del litigio, Brian Cogan, permitió inexplicablemente que Merck y los abogados de los demandantes mantuvieran la confidencialidad de la información presentada ante el tribunal. Como explicó Levin, cuyo informe también dio la noticia de nuestra Petición Ciudadana:
Algunos de estos documentos se deslizaron a través de grietas en la pared del secreto. Uno fue ingresado inadvertidamente en el registro público, permaneciendo a la vista durante un año antes de ser sellado, pero mientras tanto, se abrió camino en un oscuro archivo público, donde Reuters lo encontró. El otro fue redactado de manera defectuosa, lo que le permitió a este reportero leerlo.
Entre esos documentos se encuentran las declaraciones de Charlotte Merritt, que supervisó la actividad reguladora de Propecia, y Paul Howes, quien dirigió la comercialización del medicamento recetado.
 Merritt admitió que, en 2002, cuatro años después de que Propecia saliera al mercado, Merck modificó la etiqueta del medicamento para los eventos sexuales adversos, desde «la resolución ocurrió en todos los hombres que interrumpieron la terapia con Propecia» a «la resolución ocurrió en los hombres que interrumpieron la terapia con Propecia». » Luego testificó que Merck rechazó la palabra «todos» debido a la evidencia de los ensayos clínicos de que los eventos adversos no desaparecieron después de que los pacientes dejaron el medicamento.
Merritt admitió que, en 2002, cuatro años después de que Propecia saliera al mercado, Merck modificó la etiqueta del medicamento para los eventos sexuales adversos, desde «la resolución ocurrió en todos los hombres que interrumpieron la terapia con Propecia» a «la resolución ocurrió en los hombres que interrumpieron la terapia con Propecia». » Luego testificó que Merck rechazó la palabra «todos» debido a la evidencia de los ensayos clínicos de que los eventos adversos no desaparecieron después de que los pacientes dejaron el medicamento.
Howes admitió que Merck sabía que las advertencias de efectos secundarios sexuales, especialmente persistentes a efectos secundarios permanentes, habrían sido el beso de la muerte para las ventas de Propecia.
Un día después de que se conoció la historia de Levine, Reuters presentó una moción en el Tribunal Federal de los Estados Unidos para abrir todos los documentos presentados en el litigio de Propecia. La agencia de noticias más grande del mundo occidental argumentó que “Este es un caso de tremenda importancia que ha sido sellado sin hallazgos oficiales que expliquen ese sellado. La Primera Enmienda excluye tal resultado «.
Dieciséis meses después, el 25 de enero, la magistrada estadounidense Peggy Kuo aprobó la moción de Reuters, allanando el camino para hacer públicos todos los documentos de Merck en los litigios relacionados con Propecia.
En su decisión, Kuo señaló que los argumentos de Merck para mantener la tapa sobre esos documentos «son tan débiles que no superarían ni siquiera una baja presunción de acceso según el derecho consuetudinario».
 Cualquier persona que viva en los EE. UU. Y que padezca SLP debe informar sus síntomas a la Administración de Drogas y Alimentos de los EE. UU. Cualquier persona que viva fuera de los EE. UU. Y que padezca PFS debe informar sus síntomas a la Administración de Alimentos y Medicamentos de los EE. UU., Así como a su agencia nacional de regulación de medicamentos, como se indica en nuestra página Informar sus efectos secundarios.
Cualquier persona que viva en los EE. UU. Y que padezca SLP debe informar sus síntomas a la Administración de Drogas y Alimentos de los EE. UU. Cualquier persona que viva fuera de los EE. UU. Y que padezca PFS debe informar sus síntomas a la Administración de Alimentos y Medicamentos de los EE. UU., Así como a su agencia nacional de regulación de medicamentos, como se indica en nuestra página Informar sus efectos secundarios.
Finalmente, si usted o un ser querido padecen PFS y se sienten deprimidos o inestables, revise nuestra página de Preguntas frecuentes lo antes posible. Después de eso, no dude en ponerse en contacto con la Fundación PFS a través de nuestra línea directa de atención al paciente: social@pfsfoundation.org
Gracias.
Noticias Relacionadas
Regulatory Update: France’s FDA-Equivalent Agency Reissues Finasteride Warning (Feb. 2, 2019)
Regulatory Update: MHRA Issues Drug Safety Update on Finasteride (May 26, 2017)
